Los fabricantes están obligados a realizar una evaluación clínica de sus productos sanitarios para cumplir con el MDR
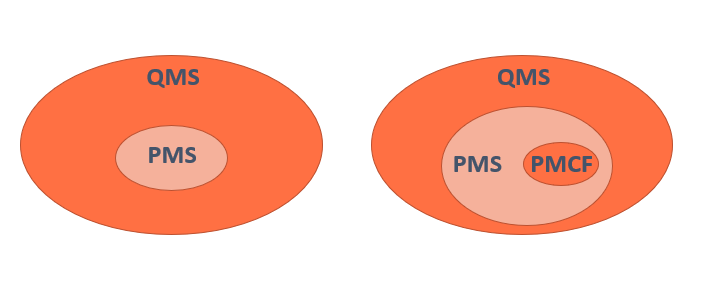
La evaluación clínica junto incluyendo el PMCF (Post Market Clinical Follow-up) es una de las partes mas importantes del cumplimiento con los GSPS del MDR. Esta evaluación clínica junto con el PMCF debe estar referenciado en el Sistema de Gestión de la Calidad o QMS (del inglés Quality Management System).
Pero, ¿cual es el principal objetivo de la Clinical Evaluation? Por un lado demostrar que existe un beneficio clínico del producto basándose en relación beneficio/riesgo y por otro asegurar que no habrá efectos no esperados ni efectos secundarios no aceptables durante su uso previsto.
La evaluación clínica se define como el proceso sistemático y planificado de generar, recoger, analizar y evaluar de forma continua los datos clínicos relativos a un producto para verificar su seguridad y funcionamiento, incluidos los beneficios clínicos, cuando se utilice conforme a la finalidad prevista por el fabricante.
De acuerdo con el artículo 61 del MDR una evaluación clínica puede basarse en lo siguiente:
- una evaluación crítica de literatura científica relevante
- una evaluación crítica de los resultados de las investigaciones clínicas disponibles
- la consideración de un tratamiento alternativo disponible en ese momento para el mismo fin si las hubiera.
Desde el punto de vista del cumplimiento con este aspecto del MDR, es importante tener en cuenta los siguientes puntos:
- tener un plan de evaluación clínica o CEP, del inglés Clinical Evaluation Plan, que nos servirá de base para la estrategia de cumplimiento que sigamos.
- establecer una metodología de búsqueda de literatura científica que de una forma comprensiva nos ayude a determinar nuestra situación en cuanto a datos clínicos.
- Elaborar una lista de afirmaciones clínicas sobre nuestro producto y dar las argumentaciones para demostrarlo.
- Enumerar una lista de actividades que serán necesarias para la PMCF según el MDR.
- Implementar el proceso de CE (Clinical Evaluation) y obtener los interfaces con el QMS.
La forma mas directa de realizar una CE es generando datos clínicos reales relativos a seguridad y comportamiento del producto pero también puede realizarse si demostramos equivalencia con otros productos similares. Esta equivalencia será la que nos proporcione como fabricantes, los datos clinicos que nos permitirá evaluar la conformidad de nuestro producto.
Podemos dividir el proceso de CE en las siguientes etapas o fases que comprenden justificar todos estos puntos que se mencionan:
- Fase 0: Ámbito y Clinical Evaluation Plan (CEP)
- Descripción del MD
- Estado del arte
- Configuración del criterio de aceptabilidad de la relaciona beneficio/riesgo
- Principales GSPR que se cumplen con la CE
- Clinical Evaluation Plan (según MDR Anexo XIV. Parte A p.1a)
- Fase 1: Identificación y generación de los datos clínicos
- Fuentes: investigaciones clínicas, datos publicados obtenidos de revisión sistemática de BBDD.
- Protocolo de búsqueda de literatura técnica
- Fase 2: Evaluación de los datos clínicos
- Relevancia de los datos clínicos
- Finalidad prevista
- Población destino
- Parámetros de funcionamiento
- Fase 3: Análisis de los datos clínicos
- Cumplimiento con los distintos GSPR aplicables
- Evaluación de la relación beneficio/riesgo
- Estado del arte
- Gap analysis para incluir o planificar investigaciones clínicas o actividades especificas de PMCF
- Fase 4: Clinical Evaluation Report (CER)
- Resumen. Ref MDCG 2019-9 sobre SSCP es útil.
- Ámbito de la CE . Ref. MDR Anexo XIV. Parte A 1.
- Conocimiento clínico actual y estado del arte. Ref. MDR Anexo XIV. Parte A 1
- Pasos de la CE:
- Tipo de evaluación realizada
- Demostración de equivalencia (si se reclama)
- Datos clínicos generados y como los conserva el fabricante
- datos clínicos provenientes de la literatura
- Resumen de la evaluación de los datos clínicos
- Análisis de los datos clínicos
- Conclusiones: GSPR que se cumplen, determinación de la relación beneficio/riesgo, gap analysis para el PMCF.
- PMCF y próxima revisión del CE. Ref. MDR Anexo XIV. Parte B.
- Fase 5: Post Market Clinical Follow-up (PMCF)
- PMCF Plan. Según MDCG 2020-7 :Guidance on PMCF plan template
- PMCF Report: Según MDCG 2020-8: Guidance on PMCF evaluation report template