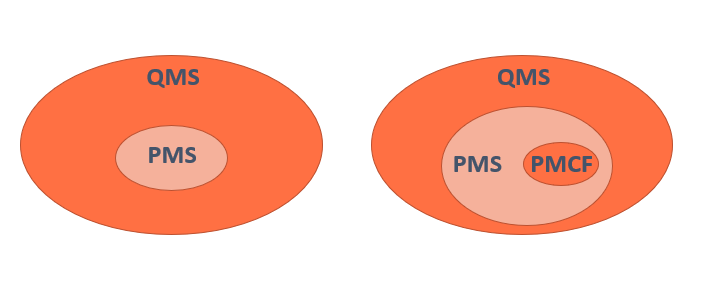
El artículo 10 del MDR obliga a los fabricantes a establecer, documentar y mantener un sistema de gestión del riesgo tal como se especifica en el Anexo I sección 1, 3 y 8. El sistema de gestión del riesgo deberá estar integrado en el Sistema General de Calidad SGC de la organización.
El sistema de gestión del riesgo será un proceso continuo e iterativo a través del ciclo de vida del producto.
La norma armonizada que nos ayuda a realizar la gestión del riesgo y el análisis de la relación beneficio/riesgo es la ISO14971:2019. Puede encontrar más información en La norma ISO14971:2019.
El riesgo se define como la relación de ocurrencia entre un peligro que podría causar daño y el grado de severidad de ese daño. O dicho de otro modo al producto de una probabilidad de un riesgo por el daño o nivel de severidad producido cuando se materializa ese riesgo.
¿Qué es un análisis de riesgos? Es el estudio de los peligros que pueden existir relacionados con la probabilidad de que estos peligros o eventos se materialicen provocando un daño con una severidad determinada.
Para ello tenemos que analizar os riesgos de una forma metódica y consistente. A continuación se muestra una manera de empezar a establecer los criterios y valores de nuestro análisis.
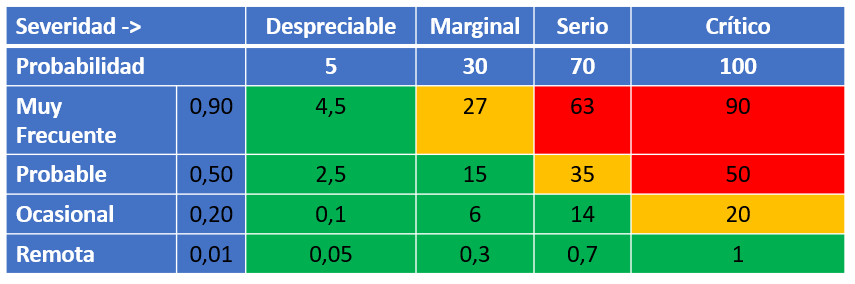
La estimación del riesgo está basada en:
- la probabilidad de cada peligro
- la severidad de la materialización de cada peligro
- en el cálculo del producto (probabilidad x severidad)
La probabilidad (P) se caracteriza por:
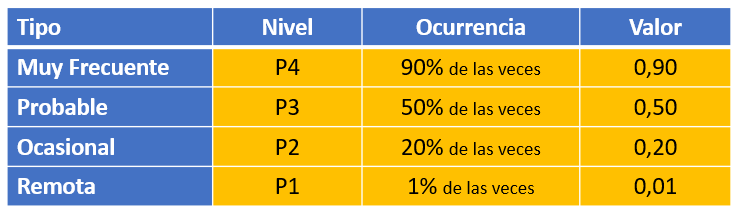
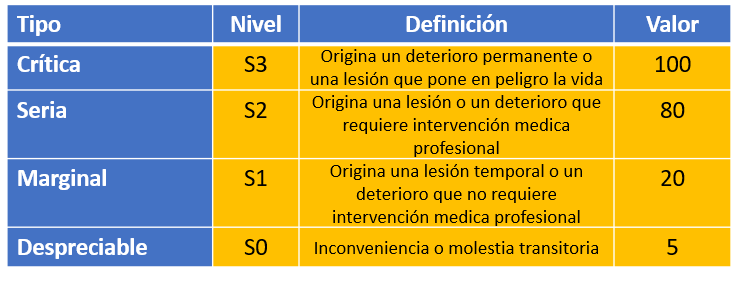
La severidad (S) se basa en los siguientes niveles como consecuencia de la materialización de los posibles peligros:
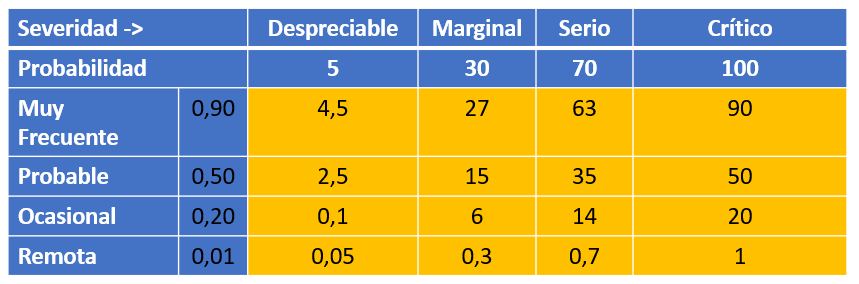
En la tabla de estimación de riesgo (probabilidad x severidad) vemos el producto de ambas variables y el valor que obtenemos de las posibles combinaciones de P y S:
Si queremos gestionar el riesgo debemos tener un criterio de aceptación del riesgo que podría responder a algo como:
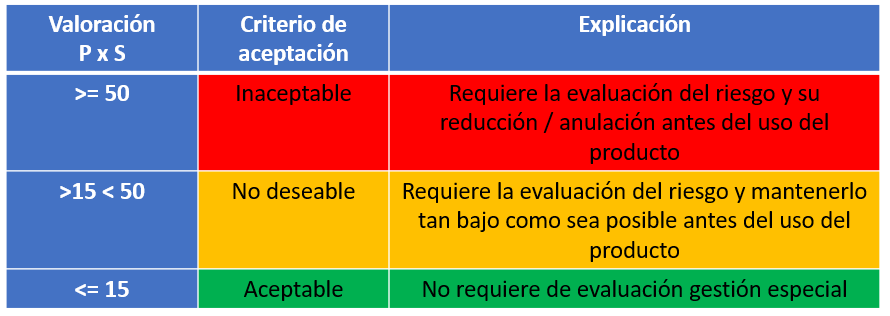
Por lo que la tabla de aceptación de riesgo aplicando los criterios de aceptación quedaría de esta manera:
Sabemos que casi todos los posibles riesgos que se producen en los productos sanitarios tienen que ver con:
- Malfuncionamiento de alarmas
- Errores de administración de medicación usando bombas de infusión
- Exposiciones innecesarias y quemaduras por radiación en los procedimientos de diagnostico por radiología.
- Datos erróneos en los historiales clínicos
- Fallos de interoperabilidad entre los productos sanitarios y los sistemas IT de salud.
- Peligros de embolia por aire
- No atención de las necesidades de pacientes pediátricos.
- Inadecuado reproceso de dispositivos endoscópicos e instrumentos de cirugía
- Distracciones de los cuidadores por teléfonos u otros dispositivos móviles
La tabla final que deberemos construir mostrará todos los riesgos identificados por tipo y deberán estar numerados para una mejor identificación. Dependiendo del producto y sus riesgos la tabla podrá ser mas o menos larga. Un ejemplo de los encabezados de la tabla podría ser el siguiente:

La gestión incluirá cómo identificamos los riesgos y de qué fuentes se obtienen y además que medidas de control de riesgo aplicamos y cómo se mitiga el riesgo aplicándolas.
De la aplicación de las medidas de control, surgirán nuevos valores de riesgo que habrá que evaluar el nivel de aceptabilidad.
El análisis y gestión de riesgos está relacionada con otros procesos de los que se realimenta y que al mismo tiempo proporciona realimentación de información, hablamos de la evaluación preclínica y de la evaluación clínica:
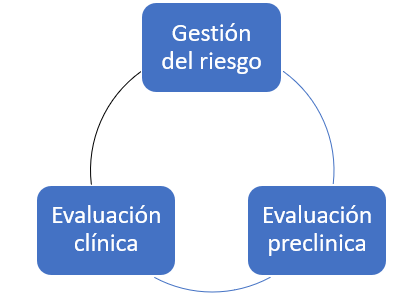
El resultado de la evaluación pre clínica se aplicará al análisis de riesgo como por ejemplo para detectar o minimizar algunos riesgos de los productos, como los que se detectan en los ensayos de laboratorio para verificar cumplimiento con seguridad eléctrica. Por otro lado el análisis de riesgos debe alimentar a la evaluación pre clínica en el sentido de que es posible que después de evaluar los riesgos residuales sea necesario aplicar algún medida de control que mitigue todavía mas dicho riesgo.
Por otro lado el output de la evaluación clínica, puede ser considerada como medida de control para reducir algún riesgo identificado o no y de la misma manera, el análisis de riesgos podría recomendar que se realice una nueva evaluación clínica por ejemplo por haber declarado una nueva finalidad prevista prevista.