El Anexo III establece la documentación técnica requerida para tener un Sistema de Vigilancia en el Mercado o PMS (Post Market Surveillance).
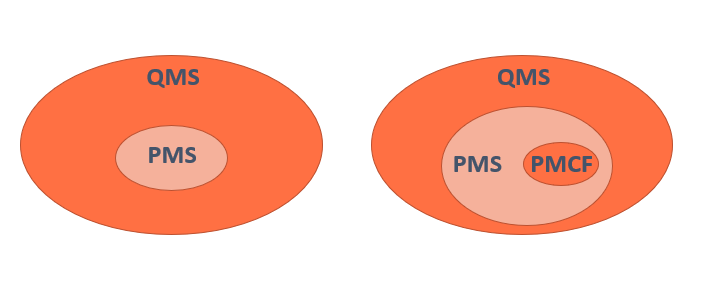
El Anexo III del MDR establece la documentación técnica que hay que tener para poder demostrar que existe un sistema PMS . Este anexo está muy relacionado con los artículos 83 al 86. Por cada producto sanitario el fabricante deberá planificar, establecer, documentar, implementar, mantener y actualizar un PMS de acuerdo con el riesgo y el tipo de producto sanitario. El PMS debe estar integrado en el Sistema de Gestión de la Calidad de la organización o QMS (Quality Management System) como se menciona en el artículo 10(9).
El PMS incluirá también un Sistema de Seguimiento Clínico Post Comercialización o PMCF (Post Market Clinical Follow-up) cuando sea aplicable.
Los objetivos del PMS son variados:
- actualizar las conclusiones sobre beneficio/riesgo al mismo tiempo que se actualiza la gestión del riesgo del producto sanitario
- identificar las necesidades de toma de acciones preventivas, correctivas o correctivas de seguridad en campo
- actualizar el diseño y la información de fabricación, las instrucciones de uso y el etiquetado
- identificar opciones de mejora de usabilidad, funcionamiento y seguridad
- actualizar la evaluación clínica
- actualizar el SSCP (Summary of Safety and Clinical Performance) del Artículo 32
- detectar y reportar tendencias de acuerdo con el artículo 88.
Un PMS debe tener obligatoriamente un plan cuyo objetivo es recoger de una forma proactiva y sistemática la siguiente información:
- información y registros sobre incidentes serios
- información y registros sobre incidentes no serios y cualquier efecto secundario no deseado
- informes de tendencia
- referencias a registros, bases de datos o literatura técnica
- información, feedback y quejas de usuarios, distribuidores e importadores
- información pública sobre productos sanitarios similares
El plan del PMS incluirá también un plan para el PMCF según el Anexo XIV Parte B.
Asimismo incluirá una serie de métodos y protocolos para:
- asegurar la recolección de los datos y poder hacer una caracterización del funcionamiento y comparación con productos sanitarios similares
- establecer indicadores y niveles de umbral que serán usados de forma continua en la relación beneficio/riesgo y en la gestión del riesgo
- investigar quejas y analizar la experiencia relacionada con el mercado
- gestionar los incidentes ocurridos del grado que sean, para crear un informe de tendencia
- comunicarlo a las partes involucradas
- poner en práctica las medidas correctoras adecuadas
- tener trazabilidad de todos los productos en el mercado
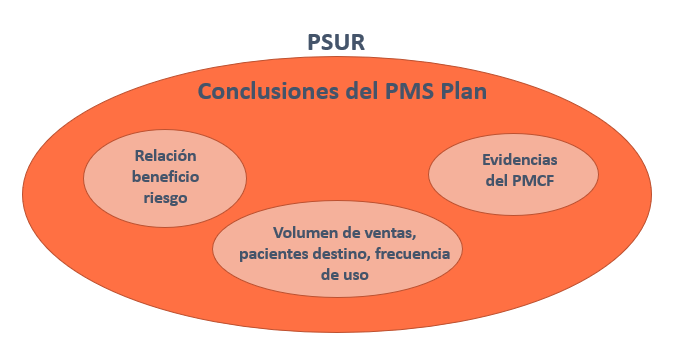
A continuación se muestra una tabla con los requisitos de comunicación y actualización para el PMSR (Post Market Surveillance Report) y para el PSUR (Periodic Safety Update Report)
| Clase | I | IIa | IIb | III |
| Tipo de informe | PMSR | PSUR | PSUR | PSUR |
| Frecuencia de actualización | Cuando sea necesario | cuando sea necesario y al menos una vez cada 2 años | al menos una vez al año | al menos una vez al año |
| Disponibilidad | disponible cuando la entidad de certificación lo requiera | disponible para el Organismo Notificado (NB) cuando lo requiera. Comunicación a EUDAMED solo si son implantables | disponible para el Organismo Notificado (NB) cuando lo requiera. Comunicación a EUDAMED solo si son implantables | Comunicación a EUDAMED solo si son implantables |