El MDR ha introducido nuevos requisitos para el Post Market Clinical Follow-up (PMCF).
Introducción
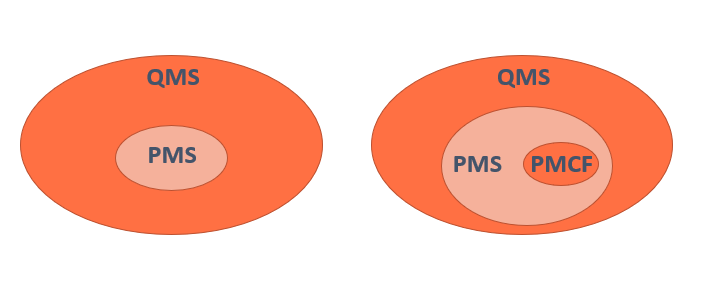
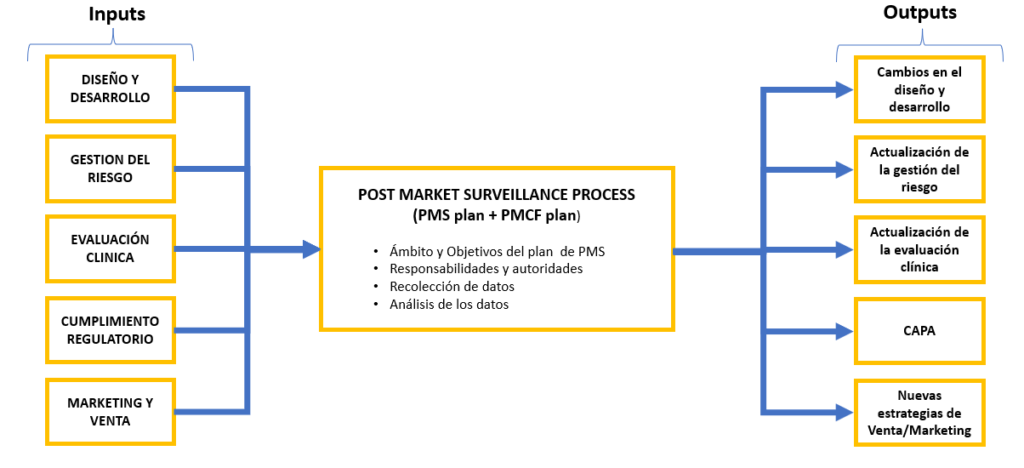
Según el MDR, el Post Market Clinical Follow-up (PMCF) será entendido como un proceso continuo, y cuya finalidad es realimentar a otros procesos con el único objetivo de mejorar la seguridad y el desempeño de los productos sanitarios durante todo su ciclo de vida.
Es precisamente la relación que tiene el PMCF con otros procesos lo que le otorga una importancia relevante:
Objetivos del PMCF
Especificar los métodos y procedimientos para que de forma proactiva se recojan y evalúen los datos clínicos de un producto sanitario puesto en el mercado, con estos propósitos:
- Confirmar la seguridad y el comportamiento del producto durante su ciclo de vida completo
- Identificar efectos secundarios desconocidos y monitorizar los conocidos y las contraindicaciones
- Asegurar de una forma continua que la relación beneficio/riesgo se mantiene
- Identificar posibles malos usos del producto por si es necesario revisar la finalidad prevista.
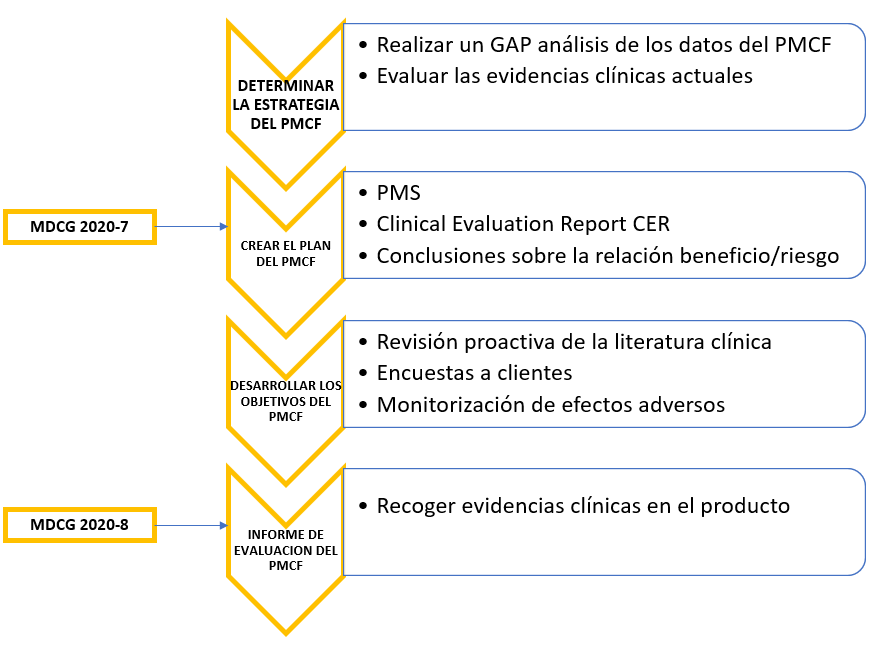
Fases del PMCF
Opciones para las actividades del estudio PMCF
El fabricante puede incluir en sus estudios PMCF actividades relacionadas con:
- Literatura clínica:
- Revisar literatura científica y estudios de productos similares de otros fabricantes
- Revisar productos con WET (Well Established Tecnology) de la competencia
- Estado del arte
- Bases de datos / registros
- Revisar BBDD y registros oficiales
- Feedback
- Encuestas a clientes
- Grupos de expertos
- Feedback recabado de los usuarios
- Estudios clínicos
- Ensayos controlados aleatorios
- Estudio de casos de control
Requisitos de un informe PMCF
Debería incluir al menos:
- Plan para el PMCF
- Los formularios de consentimiento de los pacientes
- Instrucciones de uso del producto sanitario y certificado CE
- CV de los doctores participantes
Obligatoriedad del estudio PMCF
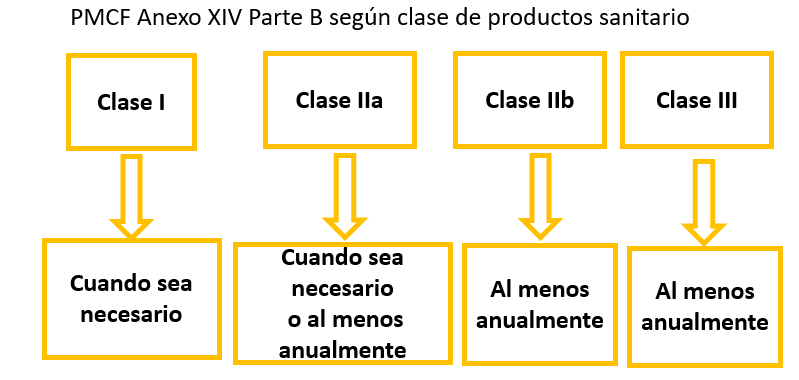
Estructura del PMCF